
取消
清空記錄
歷史記錄
清空記錄
歷史記錄



第七批國采結果公布;上海首個核酸產業園將開工;Novavax新冠重組蛋白疫苗NVX-CoV2373獲得FDA的緊急使用授權
一周快訊(0710-0715)
第七批國采結果公布;上海首個核酸產業園將開工;Novavax新冠重組蛋白疫苗NVX-CoV2373獲得FDA的緊急使用授權
官方發布
CDE:關于公開征求《申辦者臨床試驗期間安全性評價和安全性報告技術指導原則(征求意見稿)》意見的通知
隨著《藥物警戒質量管理規范》的發布和實施,申辦者應建立完善的藥物警戒體系,對臨床試驗期間的安全風險管理承擔主體責任,以充分保護受試者安全。為更好的推動和指導申辦者對臨床試驗期間的安全性信息及時評價和報告,明確技術標準和向監管機構報告的要求,我們遵照國內法律法規要求,同時借鑒國際相關技術指南制定本指導原則。
上海:第7批國采結果公布
7月12日,上海陽光藥品采購網發布《第七批國采擬中選結果》,本次集采有60種藥品采購成功,復方磺胺甲噁唑口服常釋劑型品種流標,擬中選藥品平均降價48%,按約定采購量測算,預計每年可節省費用185億元。
醫藥企業積極參與本次集采,295家企業的488個產品參與投標,217家企業的327個產品獲得擬中選資格。其中,6家國際藥企的6個產品中選,211家國內藥企的321個產品中選,投標企業中選比例73%。平均每個藥品品種有5.4家企業中選。
本次集采藥品涉及31個治療類別,包括高血壓、糖尿病、抗感染、消化道疾病等常見病、慢性病用藥,以及肺癌、肝癌、腎癌、腸癌等重大疾病用藥。肝癌一線靶向藥侖伐替尼膠囊,每粒從平均108元下降到平均18元,一個治療周期可節約費用8100元。在降血壓領域首次納入緩控釋劑型,硝苯地平控釋片降價58%、美托洛爾緩釋片降價53%,高血壓患者用藥負擔明顯減輕。抗病毒藥物奧司他韋每片從平均4.5元降至1元。此外,美國輝瑞公司的替加環素、日本安斯泰來公司的米卡芬凈、西班牙艾美羅公司的依巴斯汀、意大利博萊科信誼公司的典帕醇等4個原研藥中選,平均降價67%。
上海:首個核酸產業園將開工
近日,據官方媒體報道,上海首個核酸產業園核酸產業園將于7月中旬在上海杭州灣經濟技術開發區正式開工。
據悉,核酸產業特色園區占地3平方公里,先期將打造720畝核酸產業首發地、先行區。
作為開發區核酸產業生態圈的領軍企業,全球最大的寡核苷酸和基因單體生產企業兆維生物于2019年落戶開發區,并于2021年6月投產,目前占全球核酸原料70%的市場份額,年產值15億元。在品質能力方面,目前用于核酸疫苗的mRNA可以達到70億劑。開發區大力支持兆維生物向下游產業鏈延伸發展,組建專班全力協調危險品配建庫房設計審批等事項。今年7月,兆維生物投資25億元的小核酸藥物研發生產基地也將開工奠基。
在核酸藥物方面,除了兆維生物,開發區還集聚了國內核酸檢測試劑“芯片”的主力供應商,也是國內核酸引物的領軍企業百力格生物。此外,上藥集團將利用其在開發區的中西三維基地打造核酸藥物技術平臺;在蛋白藥物領域,美資企業昂博生物的多肽產品、保護氨基酸產品銷量全球前十;在CDMO領域,博騰制藥在收購開發區凱惠藥業后,將打造生物藥化合物研發基地,并通過擴建二期,建設核酸蛋白藥物生產基地。
世衛組織:建議各國重視猴痘流調
本周二(7月12日),世界衛生組織總干事譚德塞表示現在全球63個國家共有9200例猴痘病例。世衛組織建議各國政府實施流調,以幫助追蹤、遏制病毒以及隔離感染者,務必阻止猴痘病毒繼續傳播。
此前據美國全國廣播公司報道,截至7月8日,全美猴痘確診病例已超過700例,其中加利福尼亞州和紐約州最多,疫情正像滾雪球一般不斷蔓延。
藥企動態
Novavax:新冠重組蛋白疫苗NVX-CoV2373獲得FDA的緊急使用授權
2022年7月13日,Novavax新冠重組蛋白疫苗NVX-CoV2373獲得FDA的緊急使用授權(EUA)。
FDA已經批準4款新冠疫苗,分別為輝瑞/BioNtech和Moderna的mRNA疫苗、強生的腺病毒載體疫苗、Novavax的重組蛋白疫苗。

NVX-CoV2373為三聚體全長S蛋白疫苗,采用Matrix-M佐劑(皂苷類新型佐劑)。NVX-CoV2373已經獲得WHO、歐盟、印度尼西亞、印度、菲律賓等國的批準,此次終于獲得美國FDA的批準。
康弘藥業:生物合成1類新藥申報臨床
7月10日,康弘藥業發布公告,稱CDE同意受理其子公司弘合生物提交的 KH617臨床試驗申請,用于治療晚期實體瘤患者(包括成人彌漫性膠質瘤)。
注射用KH617是弘合生物合成生物學平臺的第一個進入臨床試驗申報的產品,是弘合生物自主研發的擬用于治療晚期實體瘤患者(包括成人彌漫性膠質瘤)的具有自主知識產權的化藥1類創新藥。
艾伯維:終止CD33單抗AL003的合作開發,治療阿爾茨海默病
近日,Alector公司向美國證券交易委員會提交的一份文件表示,艾伯維決定終止CD33單抗AL003的合作開發項目,用于治療阿爾茨海默病(AD)。
2017年10月,Alector和艾伯維達成合作,共同開發治療阿爾茨海默病和其他神經退行性疾病的新藥。根據協議條款,雙方將圍繞一個特定靶點開發抗體藥物,艾伯維有權獲得針對該靶點的2個藥物的全球開發及商業權利。艾伯維需向Alector支付2.05億美元預付款和潛在2000萬美元股權投資。(見:對抗阿爾茨海默病新思路!Alector獲得艾伯維2.05億美元投資)。
瓴路愛迪思:全球首個且唯一CD19 ADC藥物聯合療法III期臨床試驗成功完成首例患者給藥
7月11日,瓴路藥業和ADC Therapeutics SA(紐約證券交易所股票代碼:ADCT)創建的合資企業瓴路愛迪思宣布,針對旗下全球首個且唯一一個靶向CD19的ADC藥物Loncastuximab tesirine與利妥昔單抗聯合療法的LOTIS-5確證性三期全球臨床試驗在中國完成了首例患者給藥。此項臨床試驗將通過對比標準免疫化學療法,評估Loncastuximab tesirine與利妥昔單抗聯合療法針對彌漫性大B細胞淋巴瘤(DLBCL)二線及以后且不符合移植條件的患者的有效性和安全性。
作為瓴路愛迪思的主要候選產品,Loncastuximab tesirine是目前首個也是唯一一個靶向CD19的ADC藥物。多項臨床試驗顯示,Loncastuximab tesirine單藥治療在廣泛的復發/難治性彌漫大B細胞淋巴瘤、套細胞淋巴瘤和濾泡性淋巴瘤患者人群中,均表現出顯著的臨床活性。
萬泰生物:2價HPV疫苗產銷兩旺
7月11日,萬泰生物(603392)發布2022年半年度業績預告:預計2022年半年度實現歸屬于母公司所有者的凈利潤為250,000萬元到275,000萬元,與上年同期相比,將增加177,849萬元到202,849萬元,同比增加246%到281%。
萬泰生物在公告中分析業績預增的原因有兩點:二價宮頸癌疫苗繼續保持產銷兩旺,收入及利潤高速增長;因上半年國內外新冠肺炎疫情影響,公司新冠原料和新冠檢測試劑的收入及利潤實現快速增長。
福泰制藥:3.2億美元收購ViaCyte
7月11日,福泰制藥(Vertex)宣布,已與ViaCyte公司達成協議,以3.2億美元收購后者,目的是加速推進一款用于功能性治愈1型糖尿病 (T1D)的細胞療法VX-880。
通過收購ViaCyte,福泰制藥獲得了互補的資產、能力和技術,包括更多人類干細胞系、關于干細胞分化的知識產權以及細胞療法的GMP生產設施,這些可以加速Vertex正在進行的T1D計劃。此外,福泰制藥還獲得了3款在研細胞療法,其中有ViaCyte與CRISPR Therapeutics合作開發的新型低免疫干細胞資產VCTX210。
VX-880是一款研究性的異體干細胞衍生的、完全分化的、產生胰島素的胰島細胞療法,有潛力通過恢復胰島細胞功能,包括葡萄糖反應性胰島素的產生,來恢復機體調節葡萄糖水平的能力。它通過輸注到肝門靜脈中遞送,同時需要維持性免疫抑制治療來防止胰島細胞受到免疫排斥。
正序生物:堿基編輯技術獲美國專利商標局專利授權
7月12日,正序生物科學創始人團隊創建的變形式堿基編輯系統tBE(transformer Base Editor)正式獲得美國專利商標局(USPTO)專利授權,成為首個獲得海外專利授權的中國自主研發堿基編輯工具。正序生物已從上海科技大學獲得tBE的全球獨家許可,成為獨家擁有這一底層平臺型堿基編輯系統專利全球權益的生物醫藥公司。
堿基編輯技術是針對某些單一的堿基錯誤(即點突變)進行修復,并不會在DNA中造成雙鏈斷裂,可以對DNA進行精確修復。相較于現有其他基因編輯技術,堿基編輯技術有望填補CRISPR/Cas9技術無法涉及的空白領域,實現更高的編輯效率和更好的安全性。
先聲藥業:CDK4/6抑制劑獲批上市
7月13日,先聲藥業注射用曲拉西利(Trilaciclib)已獲國家藥監局批準上市。適應癥是在接受含鉑類藥物聯合依托泊苷方案的廣泛期小細胞肺癌(ES-SCLC)患者中預防性使用曲拉西利,以降低化療引起的骨髓抑制的發生率。這是全球首個且唯一具有全面骨髓保護功效的藥物,是可以減少化療導致的骨髓抑制(CIM)的一種全新療法。
中國每年新發腫瘤病例超過400萬,作為最基礎治療手段的化療,常引起骨髓抑制副作用,進而造成患者感染、貧血、自發性出血、休克甚至死亡,嚴重降低患者的生活質量,縮短生存時間。骨髓抑制一般只能在發生后通過輸血、注射生長因子或輸血小板進行“補救”,但這些療法僅能針對性改善某一類血細胞,而且可能會帶來額外的風險。因此,廣大的化療患者對于能夠改善化療副作用,又不降低抗腫瘤的療效的新療法存在迫切需求。
禮來:度拉糖肽+胰島素中國III期試驗成功
7月12日,禮來宣布其每周注射1次的長效GLP-1受體激動劑Trulicity(度拉糖肽注射液)聯合滴定的甘精胰島素治療成人2型糖尿病III期AWARD-CHN3研究達到主要和所有關鍵性次要終點,顯著降低2型糖尿病患者的糖化血紅蛋白(HbA1c)、體重及空腹血清葡萄糖。
AWARD-CHN3研究是一項在中國進行的多中心、隨機、雙盲、平行組、安慰劑對照III期臨床試驗,用以支持度拉糖肽在中國聯合胰島素治療成人2型糖尿病適應癥的申請。研究共納入291例成人2型糖尿病患者,由全國27家研究中心參與完成。入組受試者平均糖尿病病程為11.8年,基線HbA1c為8.59%,基線體重為71.85 kg,基線基礎胰島素劑量為每日18.54 IU。在接受甘精胰島素(伴二甲雙胍治療和/或阿卡波糖)治療血糖仍控制不佳的中國成人2型糖尿病患者中,聯合使用度拉糖肽1.5mg在28周HbA1c較基線的變化方面優效于聯合使用安慰劑。
再鼎醫藥:重癥肌無力新藥在國內申報上市
7月13日,再鼎醫藥宣布efgartigimod的上市申請獲國家藥監局受理,用于治療全身型重癥肌無力(MG)。這是全球首款且目前唯一獲FDA批準上市的FcRn拮抗劑,也是首個獲批的通過內源性減少致病性抗體而專門治療全身型MG的療法。
efgartigimod是由argenx公司開發的一種針對抗體介導自身免疫疾病的、高度靶向免疫球蛋白(IgG)新型治療藥物。2021年1月,再鼎醫藥與argenx達成獨家授權合作,負責efgartigimod在大中華區的開發和商業化工作,交易總額為1.75億美元。
作為全球首款FcRn拮抗劑,efgartigimod可以通過其獨特的作用機制安全快速清除體內的致病性IgG抗體,從而治療IgG介導的自身免疫疾病,包括重癥肌無力。相較于現有的治療方案,efgartigimod具有起效快、療效相對持久、安全性優等特點,尤其是對于難治型患者和可能發展為危象的患者具有顯著優勢。
蘇州星曜坤澤:國產乙肝siRNA藥物申報臨床
近日,蘇州星曜坤澤宣布,CDE正式受理了公司首個慢性乙肝治療產品HT-101注射液的臨床申請(IND)。星曜坤澤是由復星醫藥旗下復健資本新藥創新基金孵化的創新肝病治療平臺公司,HT-101是一款GalNAc偶聯的siRNA創新藥物實體,主要針對乙肝表面抗原(HBsAg)的清除。
本次IND申請的受理,意味著HT101有望成為首個進入臨床階段的國產GalNAc偶聯的siRNA乙肝產品,為全球龐大的乙肝患者群體,提供了“中國創造”的治療方案。后續星曜坤澤也即將開啟本產品海外臨床試驗的申報工作。
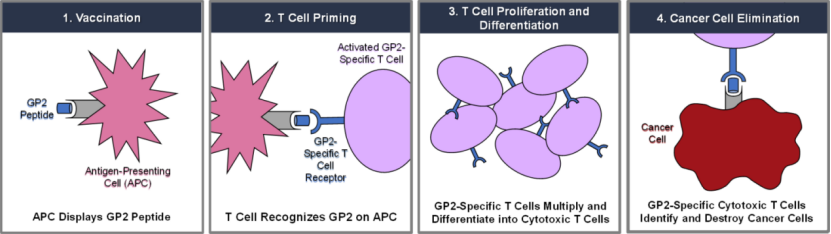
Greenwich LifeSciences:FDA解除乳腺癌疫苗GLSI-100的III期臨床暫停
7月12日,Greenwich LifeSciences公司宣布,FDA已經解除了乳腺癌疫苗GLSI-100 (GP2+GM-CSF)的III期臨床試驗暫停。
新型乳腺癌疫苗GLSI-100由GP2肽和已獲FDA批準的免疫佐劑GM-CSF組成,二者聯用可以刺激免疫反應并靶向治療HER2/neu陽性乳腺癌。GP2是HER2/neu蛋白衍生的九肽,其作用機制如下:
會議通知
2022蘇州站 改良型新藥項目立項關鍵因素探討
改良型新藥作為我國制藥行業轉型升級的重要方向之一,在需求端、政策端和技術端的三大驅動因素下迎來高速發展。憑借其研發風險低、生命周期長、回報收益高等特點,一度成為我國新藥研發的主流。改良型新藥迎來發展藍海的同時,也面臨諸多挑戰,需從臨床需求出發,有序研發,不能為改而改。盲目立項,跟風立項早已成為過去式。進行有效篩選、精準立項,加之利用前沿技術、高效策略以此實現臨床需求、增效減毒、提高順應性和產品質量,這才是現在改良型新藥研發成功的關鍵。
主辦單位 | 長沙都正生物科技股份有限公司、藥智網
時 間 | 2022-07-20 至 2022-07-20
地 點 | 中國·蘇州
融資進行
Kernal Biologics:融資2500萬美元
7月7日,mRNA技術公司Kernal Biologics宣布完成由Hummingbird Ventures領投的2500萬美元A輪融資,Amgen Ventures、HBM Genomics和Civilization Ventures等機構參投。本輪融資將進一步擴展Kernal的mRNA 2.0技術平臺,促進Kernal抗腫瘤藥物KR-335的IND申請。
mRNA 2.0技術平臺是一個由機器學習支持的技術平臺,通過對比不同細胞類型、不同疾病狀態的轉錄組與翻譯組學數據庫,發現細胞特異性mRNA序列特征,并在設計mRNA藥物時融入這些序列特征,實現mRNA藥物的特異性靶向。
思珞賽:完成逾千萬美元Pre-A輪融資
北京思珞賽生物科技有限公司(以下簡稱“思珞賽”)宣布完成逾千萬美元Pre-A輪融資,本次融資將用于公司程序化藥物遞送平臺TAXYTM的建設及CDMO業務推廣。諾輝創投與另一家知名醫療投資基金共同領投。
思珞賽專注于新型納米藥物,尤其是外泌體相關的創新藥物研發和應用,并致力于外泌體本身及其作為藥物遞送載體的創新技術開發和臨床應用轉化。目前,公司擁有近千平米的研發和生產基地,依托自有的外泌體藥物研發平臺和完備的GMP生產和質控體系,具備從實驗室級別到工業級別的外泌體量產能力。同時,公司還對外提供外泌體領域相關的科研服務和CDMO業務。
女媧生命:獲數千萬Pre-A輪投資
擁有新一代輔助生殖技術的創新公司廣州女媧生命科技有限公司(以下簡稱“女媧生命”)繼2021年完成天使輪、天使輪+融資后,于2022年4月成功完成數千萬元Pre-A輪融資。本輪融資由科金控股、浙粵投資、國聚創投、澤潤資本、磊梅瑞斯等共同完成。
女媧生命通過自主創新,開發了使用DNA甲基化圖譜進行AI智能篩選優質胚胎的方法——胚胎植入前DNA甲基化篩查技術(Pre-Implantation Methylation Screening, PIMS),該技術能夠同時檢測胚胎染色體拷貝數變異和DNA甲基化水平的信息,并結合AI智能算法對胚胎發育質量進行智能篩選,為輔助生殖醫學帶來了全新的技術理論和解決方案,極大地解決了輔助生殖醫學面臨的技術挑戰,為提高生育率提供了保障。
EPIC BIO:A輪融資5500萬美元
7月12日,致力于通過表觀遺傳工程徹底改變基因醫學的生物技術公司EPIC BIO宣布完成5500萬美元A輪融資。該輪融資得到了Horizons Ventures(維港投資)和全球其他領先投資者的支持。所獲資金將用于推進公司強大的臨床前管線和正在進行的開發工作。
Epic總部位于美國加利福尼亞州,正在基于表觀遺傳工程構建世界領先的治療平臺。該公司由CRISPR先驅亓磊博士(師從諾獎得主Jennifer Doudna教授)創建,使命是開發一類作用于表觀基因組的新型基因藥物。
Athenex:1.24億元出售中國原料藥工廠
2022年7月11日,美國納斯達克上市公司Athenex發布公告,Athenex及其附屬公司已經達成協議,將其位于中國的API原料藥工廠,以1.244億元人民幣(或1900萬美元)的價格,出售給泰和中投投資基金管理(北京)有限公司(英文原為:TiHe Capital(Beijing)Co.,LTd. 據企查查數據庫等判定為此公司




 瀏覽器自帶分享功能也很好用哦~
瀏覽器自帶分享功能也很好用哦~




